绿叶制药集团合作伙伴PharmaMar于近日宣布,其抗肿瘤创新药Lurbinectedin的多项临床研究将在2022年美国临床肿瘤学会(ASCO)年会期间展示。本届ASCO年会将于2022年6月3日-7日(美国当地时间)在芝加哥以在线及线下形式召开。
Lurbinectedin于2020年获得美国食品药品监督管理局(FDA)的加速批准,用于治疗接受铂类药物化疗期间或期后出现疾病进展的复发性小细胞肺癌(SCLC)成人患者。绿叶制药拥有Lurbinectedin在中国的开发及商业化权利。
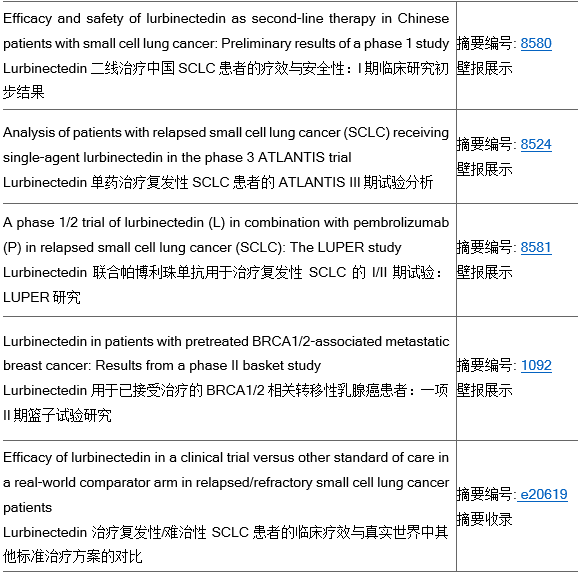
本届ASCO年会上,Lurbinectedin展示的主要临床研究包括:
1. 题为“Lurbinectedin二线治疗中国SCLC患者的疗效与安全性:I期临床研究初步结果”的壁报,将展示Lurbinectedin单药治疗的I期临床试验相关数据。研究显示:Lurbinectedin已在中国复发性SCLC患者的二线治疗中展现出积极的疗效潜力、良好的耐受性与可控的安全性。该I期临床试验由绿叶制药主导推进。
2. 题为“Lurbinectedin单药治疗复发性SCLC患者的ATLANTIS III期试验分析”的壁报,将展示ATLANTIS III期试验中的一组50名SCLC患者的亚组研究结果。这些患者在接受10个周期的2.0mg/m2 Lurbinectedin与多柔比星的联合治疗后,继续使用3.2mg/m2批准剂量的 Lurbinectedin进行单药治疗。研究显示:相比联合用药,患者转用Lurbinectedin单药治疗后,能够维持甚至改善肿瘤缓解情况,包括提高完全缓解率(CR);这些患者的总生存期(OS)良好,中位生存期为20.7 个月,且未发现新的毒性。
3. 题为“Lurbinectedin联合帕博利珠单抗用于治疗复发性SCLC的I/II期试验:LUPER研究”的壁报,将展示该试验的I期结果。研究显示:Lurbinectedin联合帕博利珠单抗在复发性SCLC患者的二线治疗中展现出可控的安全性和初步的抗肿瘤活性,该试验的扩展阶段已在进行中。
4. 题为“Lurbinectedin用于已接受治疗的BRCA1/2相关转移性乳腺癌患者:一项II期篮子试验研究”的壁报,将展示Lurbinectedin作为单药用于BRCA1/2 相关乳腺癌患者队列的II 期试验数据。该试验证实了此前在该适应症中所观察到的Lurbinectedin 的活性。
展示信息如下:

###
关于Lurbinectedin
Lurbinectedin是从海鞘 Ecteinacidia turbinata 中分离出的海洋化合物 ET-736 的衍生物,ET-736中的氢原子被甲氧基取代。Lurbinectedin能够选择性地抑制多种肿瘤所依赖的致癌基因转录。除了其对癌细胞的直接作用,Lurbinectedin还能够抑制肿瘤相关巨噬细胞中某些对肿瘤生长至关重要的细胞因子的转录和产生。
截止目前,Lurbinectedin已在美国获得加速批准,以及在澳大利亚、阿联酋、加拿大、新加坡获得临时批准,用于治疗接受铂类药物化疗期间或期后出现疾病进展的复发性小细胞肺癌成人患者。
关于Lurbinectedin在中国的开发
绿叶制药集团与PharmaMar于2019年就Lurbinectedin达成授权研发和商业化协议,绿叶制药获得该药物在中国开发及商业化的独家权利,包括小细胞肺癌在内的所有适应症。另外,绿叶制药有权在协议期内,要求PharmaMar进行Lurbinectedin制剂的生产技术转移,由绿叶制药在中国生产。目前,绿叶制药已在中国香港提交Lurbinectedin的新药上市申请。

